Obsah
Ostatné oddielyAtómy sú stavebnými kameňmi všetkej hmoty. Rôzne druhy atómov sa označujú ako „prvky“ a zostavujú sa do grafu nazývaného periodická tabuľka. Tabuľka umožňuje zoskupenie podobných prvkov na základe ich chemických vlastností. Je zaujímavé, že atómy v rovnakej skupine majú často tiež podobné fyzikálne vlastnosti. Ak chcete porozumieť chemickým a fyzikálnym vlastnostiam atómov, naučte sa rozdeliť periodickú tabuľku na skupiny a študujte každú z vlastností každej skupiny.
Kroky
Metóda 1 z 3: Delenie periodickej tabuľky
Vyhľadajte nekovové prvky. V periodickej tabuľke je väčšina atómov klasifikovaná ako kovy. Ostatné atómy sú klasifikované ako nekovy. Tieto zoskupenia budú užitočné pri skúmaní vlastností rôznych atómov.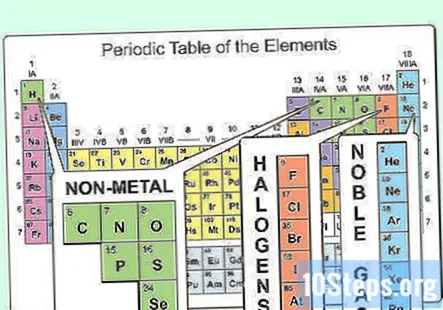
- Nekovy nájdete predovšetkým v pravom hornom rohu periodickej tabuľky, zatiaľ čo zvyšok tabuľky tvoria predovšetkým kovy. Vodík je výnimkou z tohto pravidla, pretože za štandardných podmienok funguje ako nekov, ale nachádza sa v ľavom hornom rohu tabuľky.
- Uhlík, dusík, kyslík, vodík, síra a vzácne plyny (prvky v stĺpci úplne vpravo) sú všeobecne známe nekovy.
- Halogény (ako fluór, chlór, bróm atď.) Patria do nekovovej kategórie.

Odlíšte hlavné kovové zoskupenia. Kovy sú zoskupené do podkategórií. Prvky v týchto podkategóriách sú si podobnejšie aj konkrétnejšími spôsobmi, ako je identifikácia oboch ako kovov. Bežné kategórie sú alkalické kovy, kovy alkalických zemín, prechodné kovy, kovy po prechode, lantanidy a aktinidy.- Alkalické kovy sú veľmi reaktívne a ľahko ionizovateľné do stavu 1.
- Kovy alkalických zemín sú o niečo menej reaktívne, ale ľahko ionizujú do stavu 2.
- Prechodné a post prechodné kovy sú stabilnejšie a majú veľa rôznych ionizačných stavov.
- Lantanidy a aktinidy sú väčšie, menej stabilné molekuly, ktoré ľahko reagujú. Niektoré z nich sa rozkladajú, vďaka čomu sú rádioaktívne.

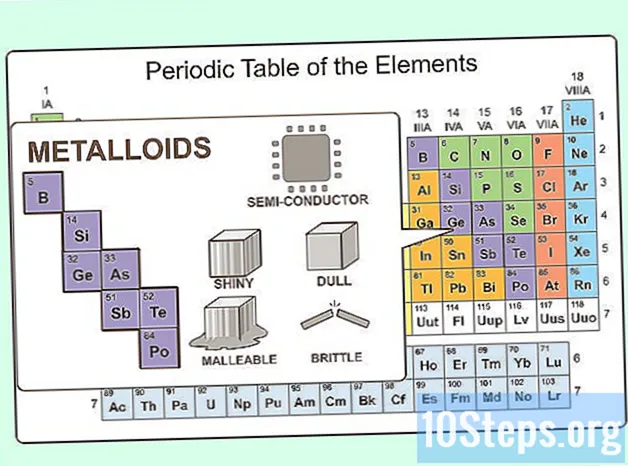
Predstavte si niečo medzi kovom a nekovom. Takéto prvky existujú a sú známe ako metaloidy. Na periodickej tabuľke sú metaloidy medzi kovmi po prechode a nekovmi. Existuje osem metaloidov:- Bór
- Kremík
- Germánium
- Arzén
- Antimón
- Telúr
- Polónium
- Astatín
Metóda 2 z 3: Analýza chemických vlastností

Pozrite sa na poradie tabuľky. Keď sa pozriete na periodickú tabuľku, všimnete si, že všetky prvky sú očíslované. Toto číslovanie nie je ani zďaleka náhodné. V skutočnosti je známe ako atómové číslo pre konkrétny prvok a rovná sa počtu protónov, ktoré má prvok v jadre.- Atómy (nie ióny) predstavuje atómové číslo tiež počet elektrónov v atóme. Počet protónov a elektrónov v atóme je rovnaký.
- Na niektorých periodických tabuľkách si všimnete druhé číslo, ktoré je menším písmom. Toto je priemerná atómová hmotnosť pre tento prvok.
Vizualizujte valenčné elektróny. Valenčné elektróny sú elektróny v najvzdialenejšom obale elektrónového mraku atómu. Valenčné elektróny sú jediným najväčším faktorom v tom, ako bude atóm chemicky reagovať. Najstabilnejšia konfigurácia pre atóm je mať naplnené elektróny v jeho vonkajšom obale, preto sa nebude viazať s inými atómami. Vo väčšine prípadov musí vonkajší obal obsahovať osem elektrónov, aby bol plný (v závislosti od veľkosti atómu sa to môže líšiť).
- Napríklad fluór má deväť elektrónov. Prvé dva vypĺňajú najvnútornejšiu obežnú dráhu, zvyšných sedem sú valenčné elektróny. To znamená, že fluór potrebuje na naplnenie svojej valenčnej škrupiny iba jeden ďalší elektrón. Fluór teda ľahko reaguje s atómami, ktoré sa môžu vzdať elektrónu (najmä kovov).
- Príkladom opaku je lítium. Lítium má tri elektróny. Prvé dva vypĺňajú najvnútornejšiu škrupinu a posledná je valenčný elektrón. Pretože lítium by na naplnenie svojej valenčnej škrupiny muselo získať sedem elektrónov, je pre neho jednoduchšie (energeticky priaznivejšie) zbaviť sa jedného valenčného elektrónu, ktorý má. Lítium teda ľahko reaguje s prvkami, ktoré prijmú elektrón (napríklad halogény).
Zvážte veľkosť atómu. Aj keď valenčné elektróny sú najlepším prediktorom chemických vlastností v danom atóme, záleží aj na veľkosti atómu. Väčšie atómy majú viac elektrónov medzi jadrom a valenčnými elektrónmi, čo znamená, že sú k atómu držané voľnejšie ako na menších atómoch. Toto vysvetľuje, prečo dva atómy s rovnakým počtom valenčných elektrónov (napríklad fluór a chlór) majú podobné, ale nie identické, chemické vlastnosti.
Naučte sa trendy periodickej tabuľky. Znalosť periodických trendov vám môže pomôcť rozpoznať pravdepodobné chemické vlastnosti prvku na základe jeho umiestnenia v periodickej tabuľke. Je však potrebné pamätať na to, že tri skupiny (vzácne plyny, lantanoidy a aktinidy) tieto trendy kvôli svojej jedinečnej chémii nesledujú. Niektoré periodické trendy sú:
- Atómová hmotnosť sa zvyšuje zľava doprava a zhora nadol.
- Atómový polomer sa zmenšuje zľava doprava a zväčšuje sa zhora nadol.
- Elektronegativita sa zvyšuje zľava doprava a klesá zhora nadol.
- Ionizačná energia sa zvyšuje zľava doprava a klesá zhora nadol.
- Elektrónová afinita sa zvyšuje zľava doprava a klesá zhora nadol.
- Kovový znak sa zmenšuje zľava doprava a zvyšuje sa zhora nadol.
Metóda 3 z 3: Skúmanie fyzikálnych atribútov
Identifikujte nekovové vlastnosti. Nekovy existujú pri troch teplotách v tuhej fáze (tuhá látka, kvapalina a plyn), ale primárne sú to plyny pri izbovej teplote. Nekovy sú zvyčajne matné a krehké, ak sú pevné, zvyčajne sa topia a varia pri nižších teplotách ako kovy. Nekovy sú tiež zlým vodičom tepla a elektriny.
- Jediným nekovom, ktorý je pri izbovej teplote kvapalina, je bróm.
- Uhlík má najvyššiu teplotu topenia zo všetkých prvkov.
Poznať fyzikálne vlastnosti kovov. Kovy sú lesklé a tvárne. Tiež dobre vedú teplo a elektrinu. Kovy sú pri izbovej teplote väčšinou tuhé, hoci ortuť je kvapalina. Kovy majú všeobecne vysoké teploty topenia a varu v porovnaní s nekovmi.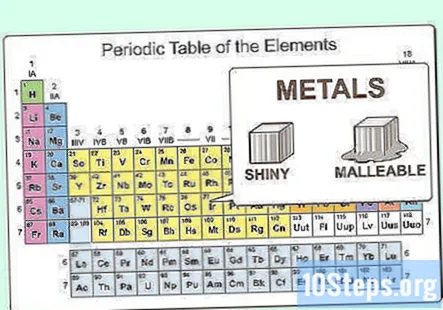
Všimnite si vzácne plyny. Prvky, ktoré tvoria krajný pravý stĺp, sú známe ako vzácne plyny. Sú chemicky inertné a všetky sa nachádzajú v plynnej fáze pri teplote miestnosti. Tieto plyny sa používajú napríklad na plnenie balónov a svetelných značiek.
Zvážte metaloidy. Rovnako ako metaloidy majú chemické vlastnosti kovov aj nekovov, majú fyzikálne vlastnosti oboch. Sú to polovodiče. Môžu byť tvarovateľné alebo krehké. Môžu byť tiež lesklé alebo matné.
Otázky a odpovede pre komunitu
Nemá elektronegativita zväčšovať skupinu?

Vedecká výskumná pracovníčka Meredith Juncker je kandidátkou na PhD v odbore biochémie a molekulárnej biológie na Louisiana State University Health Sciences Center. Jej štúdie sú zamerané na bielkoviny a neurodegeneratívne choroby.

Tipy
- Môžete si vytvoriť poznámkové lístky na štúdium rôznych skupín prvkov.
- Ak máte pri skúškach a testoch povolené používať periodickú tabuľku, môžete pomocou nej nájsť veľa odpovedí.
Varovania
- Periodická tabuľka obsahuje veľa informácií. Urobte si čas a študujte každý deň, namiesto toho, aby ste si to udržali v jednom napchatom sedení.